产品中心
PRODUCT CENTER

硼酸盐亲和磁珠
|
货号 |
产品名称 |
产品规格 |
|
|
|
EC101 |
BcMag™ 硼酸盐基磁珠 |
250 mg |
|
|
|
EC102 |
BcMag™硼酸盐基磁珠 |
500 mg |
|
|
产品属性 |
|
|
组成 |
间氨基苯基硼酸盐连接的二氧化硅包覆磁珠 |
|
磁珠大小 |
直径5µm |
|
磁力大小 |
40-45 EMU/g |
|
磁化类型 |
超顺磁性 |
|
有效密度 |
2.5g/ml |
|
状态 |
冻干粉 |
|
结合能力 |
~2μmol硼酸盐/mg磁珠 |
|
存储 |
收到后,储存在4C° |
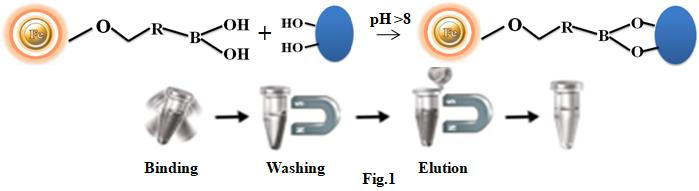
亲和纯化法是分离生物化合物的常用方法。其中,硼酸盐亲和层析是一种非常独特的纯化技术,因为在基质上连接的配体(间氨基苯基硼酸),在pH 8-9下可以特异性和可逆性地结合,含有顺式二醇邻二醇化合物的物质,并在pH 3-4条件下,在含有山梨醇的缓冲液中将其分离出去(图1)。硼酸盐亲和树脂可以从复杂生物样品(如人血清)中有效富集含顺二醇化合物(如醇类、核苷、核苷酸、核酸、碳水化合物、糖蛋白和酶)的有效实验工具。尽管目前有大量的基于硼酸盐亲和性质的不同材质产品(如纯化柱)可用,但这些产品存在操作程序繁琐、耗时,并且无法处理非常微小体积的样品(如癌细胞靶向和单细胞分析)等缺点。我们开发了一种全新的、有效的磁力亲和系统来克服这些限制。
BcMagTM Boronate Affinity Magnetic Beads是均匀的,二氧化硅包裹氧化铁的超顺磁珠,表面连接有高密度硼酸基团。该磁珠作为固体材料,可以完美地用于含顺二醇化合物的各种亲和纯化。由于其含有磁性,磁性材料可以很容易地适应高通量分析的自动化系统。
操作流程
亲和纯化操作方法非常简单(图1)。1.将磁珠直接添加到样品中。2.吹吸或旋涡混匀,以捕获目标生物分子。3.从样品中用磁力分离磁珠。4.洗涤磁珠,以去除非特异性结合的分子。5.洗脱目标分子。这款便于操作的磁珠显著改善了实验结果,其对小体积样本的操作结果,普遍优于标准滴柱法和分批法。
特点及优势
l 操作简单,易于使用
l 极低的非特异性结合
l 非常高的结合容量和在温和条件下洗脱结合的含有邻位二醇基的分子
l 易于使用
l 可靠的,可重复性的实验结果
l 性价比高:无需纯化柱、过滤器和费力的重复移液过程
l 适用于高通量:与许多不同的自动化液体处理系统兼容
操作协议
使用者需准备材料
· Binding/Wash Buffer: 50 mM HEPES, pH 8.5
提示:对于某些糖蛋白,向Binding/Wash Buffer中添加20-50 mM Mg2+,可以提高磁珠对它的结合能力。但是,这种方式也可能会导致更高的非特异性结合。因此,我们建议进行滴定以优化Mg2+的浓度。
· Elution Buffer:100 mM 山梨醇, 50 mM HEPES, pH 8.5
磁力分离器
|
Item |
Source |
|
离心管式磁力分离器
** 根据实验时生物样品的体积,使用者可以选择一下不同型号的磁力分离器 |
· BcMag™ separator-2可以容纳两个单独的1.5 ml离心管(Cat.# MS-01); · BcMag™ separator-6可以容纳六个单独的1.5 ml离心管(Cat.# MS-02); · BcMag™ separator-24可以容纳24个单独的1.5-2.0 ml离心管(Cat.# MS-03); · BcMag™ separator-50可以容纳一个单独的50 ml离心管,一个15ml的离心管,以及四个1.5ml离心管(Cat.# MS-04); |
|
BcMag 96孔磁力分离器. |
· BcMag 96-孔磁力分离器(单面) 可与96孔PCR板和96孔微孔板或其他型号离心板兼容使用 (Blioclone, Cat#: MS-06) |
|
可调式单通道和多通道移液器 |
|
实验过程
重要提示:
l 以下方案是糖蛋白纯化的实例。强烈建议在实验过程中进行滴定优化,以确定每个实验中应用的磁珠数量。该协议可以相应地放大和缩小。
l 不要使用含有有机溶剂的缓冲液。
A.磁珠的准备
1.用Binding/Wash Buffer将磁珠重新悬浮至50mg/ml。
l 提示:分液前将磁珠混匀是非常重要的步骤,不要让混匀的磁珠静置超过两分钟,使用时每两分钟混匀一次磁珠
2.向试管中加入适量的磁珠,将试管放在磁力分离器上1-3分钟。当磁珠完全沉淀时,
去除上清液。
3.取下试管,用10倍体积的Binding/Wash Buffer彻底重新悬浮磁珠。将试管在室温下放
置2-3分钟。再将试管放在磁力分离器上1-3分钟。当磁珠完全沉淀时,去除上清液。
4.重复步骤3一次。
5.取下试管,用10倍体积的Binding/Wash Buffer彻底重新悬浮磁珠。将试管放在磁力分
离器上1-3分钟。当磁珠完全沉淀时,去除上清液。
6.重复步骤5一次。
7.用1倍体积的Binding/Wash Buffer彻底重新悬浮磁珠。
B.样品的结合技清洗
1.用15倍体积的Binding/Wash Buffer稀释样品。
2.将清洗过的磁珠添加到稀释样品中,用移液器吹吸将磁珠充分混合,并在室温下轻轻震动10分钟。
3.将试管放在磁力分离器上1-3分钟。当磁珠完全沉淀时,去除上清液。
4.从磁力分离器中取出试管,并用15倍体积的Binding/Wash Buffer洗涤磁珠。
5.重复步骤3-4,直到280nm处的吸光度接近0.001。
6.用1倍体积的Binding/Wash Buffer彻底重新悬浮磁珠。
C.洗脱
1.从磁力分离器上取下试管
2.用10-20μl的 Elution Buffer重新悬浮磁珠,通过上下吹吸移液20-30次洗脱目标生物分子。
3.将试管放置在磁力分离器上1-3分钟,并将含有洗脱蛋白的上清液转移到新试管中。
D.问题排除
|
问题 |
可能原因 |
建议 |
|
回收率低 |
Binding buffer或者样品中的pH 值不在 8.0–8.5范围内. |
检查结合缓冲液和样品pH值,确保其在8.0–8.5范围内 |
|
不结合 |
一些特异性糖基化蛋白与磁珠结合性不好。 |
向结合缓冲液中添加额外的最佳浓度的Mg2+ |
|
非特异性结合 |
l 添加到样品中的磁珠过多 l 清洗不够充分 l 样品中含有糖类,或非目标分子的含有邻二醇基团的分子。 |
· 优化样品与磁珠的添加比例 · 洗涤样品直至280nm处的吸光度接近0.001。 · 增加Binding/Wash Buffer中的NaCl浓度 · 运行PD-10纯化柱以除去低分子量多糖。 |



